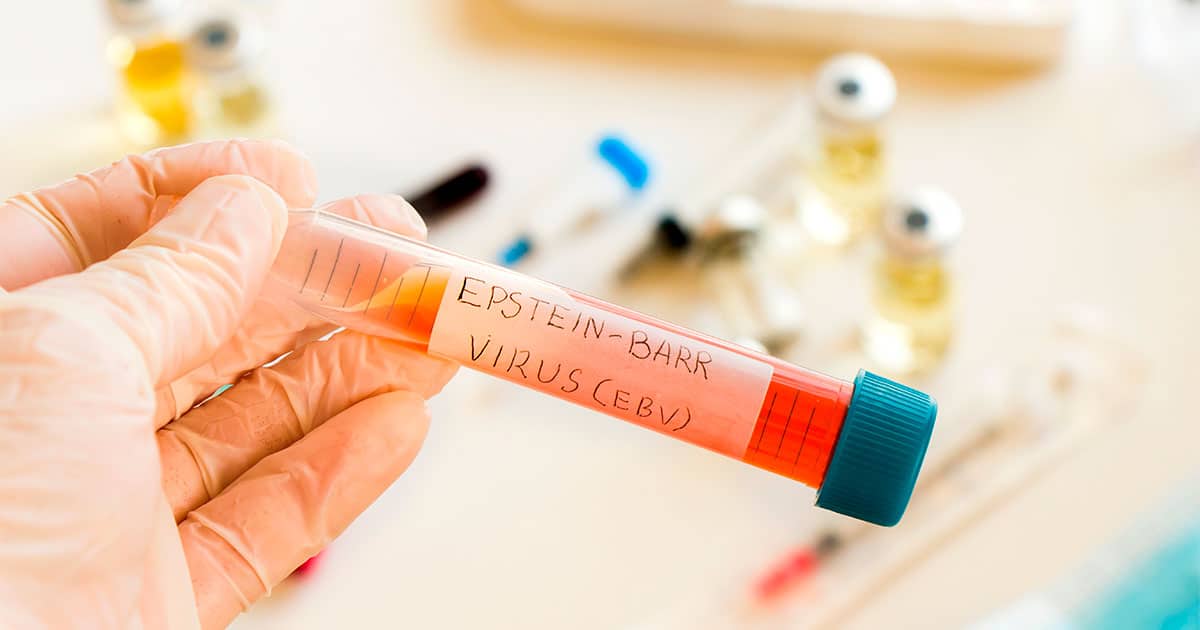
Un equipo de investigadores de la Universidad de California San Diego ha desentrañado un mecanismo crucial que explica cómo el virus de Epstein-Barr (VEB), también conocido como virus del herpes humano 4, puede desencadenar el desarrollo de diversos tipos de cáncer. Aunque este virus es extremadamente común en los seres humanos y la mayoría de las personas lo albergan de forma latente, su asociación con enfermedades ha sido motivo de preocupación.
El estudio, publicado recientemente en la prestigiosa revista «Nature», se centró en una proteína viral codificada por el VEB llamada EBNA1. Los científicos descubrieron que esta proteína tiene la capacidad de unirse a una región frágil del cromosoma 11 humano y provocar su rotura. La presencia de EBNA1 en niveles suficientemente altos es necesaria para que ocurra este fenómeno, lo que indica una dependencia de la dosis.
De particular interés es la ubicación cercana de dos genes relevantes para el cáncer: el gen ATM, un supresor tumoral que a menudo se altera en ciertos tumores, y el gen MLL, un regulador de la expresión que suele estar implicado en reorganizaciones cromosómicas en diferentes tipos de leucemia.
El equipo de investigación también examinó muestras de tumores humanos y encontró que aquellos positivos para la presencia del virus de Epstein-Barr presentaban una mayor frecuencia de alteraciones estructurales en el cromosoma 11. Además, incluso se detectaron casos de tumores negativos para el virus que mostraron alteraciones en dicho cromosoma, lo que sugiere que la acción de EBNA1 puede ocurrir sin la detección directa del virus.
Avance en el conocimiento del virus de Epstein-Barr
Los hallazgos de este estudio proporcionan una mejor comprensión de los mecanismos mediante los cuales el virus de Epstein-Barr puede promover el desarrollo de tumores. Específicamente, muestran cómo el virus puede inducir cambios cromosómicos que tienen el potencial de afectar genes relacionados con el cáncer.
La relevancia clínica de este descubrimiento es significativa. Por un lado, brinda la posibilidad de identificar el riesgo individual de desarrollar enfermedades asociadas a la infección por el virus de Epstein-Barr, basándose en características específicas del cromosoma 11. Por otro lado, abre nuevas oportunidades para el desarrollo de terapias que bloqueen la unión de EBNA1 al cromosoma 11, lo que podría prevenir la inestabilidad cromosómica y los procesos de enfermedad asociados.
La Dra. Julia Li, autora principal del estudio e investigadora de la Universidad de California en San Diego, señaló: «Este descubrimiento sugiere que la susceptibilidad del cromosoma 11 a la fragmentación inducida por EBNA1 depende de los niveles controlados de EBNA1 en la infección latente, así como de la variabilidad genética en el número de secuencias similares al virus de Epstein-Barr presentes en el cromosoma 11 en cada individuo».
Este avance en el conocimiento del virus de Epstein-Barr tiene implicaciones prometedoras para la medicina.