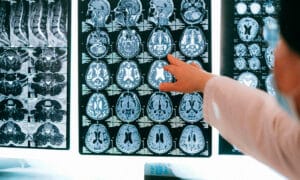
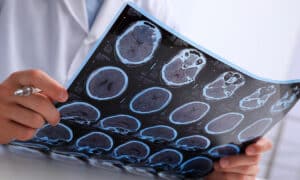
Alrededor de 50 millones de personas en todo el mundo padecen demencia y, cada año, hay casi 10 millones de casos nuevos, según la Organización Mundial de la Salud. Además, la forma más común de demencia es el alzhéimer, que representa el 60-70% de los casos.
Si bien los tratamientos farmacológicos ayudan a reducir los síntomas de la enfermedad y mejoran la calidad de vida de las personas, ni retrasan su progresión ni la curan. De hecho, los cerebros de las personas con alzhéimer contienen placas distintivas entre las células nerviosas, así como grupos de fibras conocidas como ovillos neurofibrilares dentro de las células.
Estas placas consisten en una proteína llamada beta-amiloide, mientras que otra proteína llamad tau, forma los rendedos.
Un objetivo prometedor
En este sentido, investigadores de la Universidad de Lancaster, en el Reino Unido, creen que la tau podría ser un objetivo farmacológico más prometedor para la enfermedad de Alzheimer. Es más, investigaciones previas encontraron que, en ausencia de los enredos neurofibrilares tau, el beta-amiloide no parece dañar las células nerviosas.
Además, el número de enredos en el cerebro parece ser un indicador mucho mejor de la gravedad de la enfermedad que el número de placas amiloides. En las células cerebrales sanas, las proteínas tau ayudan a estabilizar la red interna de tubos microscópicos, o “microtúbulos”, que transportan nutrientes y otras moléculas alrededor de las células nerviosas.
En la enfermedad de Alzheimer, estas moléculas de tau se separan de los microtúbulos y comienzan a unirse para formar hilos y, finalmente, enredos. A su vez, estos interrumpen la red de transporte de microtúbulos.
Los científicos creen que los compuestos que evitan que las moléculas de tau se agreguen de esta manera podrían ser tratamientos prometedores para le enfermedad de Alzheimer.
Microscopio gigante
Para evaluar la capacidad de más de 80 compuestos de bloquear la formación de enredos, los investigadores utilizaron una técnica poderosa, el dicroísmo circular de radiación sincrotrón, para obtener imágenes de los cambios estructurales en las proteínas.
Esta técnica implica iluminar muestras con haces de luz 10 mil millones de veces más brillantes que el sol. La fuente de luz de diamante (DLS) del Reino Unido, que los expertos han comparado con un microscopio gigante, generó esta luz para el estudio.
Uno de los compuestos que el DLS identificó fue la hormona epinefrina, que estabilizó las proteínas tau y evitó que formaran nudos. Sin embargo, el cuerpo metaboliza rápidamente la epinefrina, por lo que los investigadores analizaron cuatro medicamentos existentes con estructuras químicas muy similares.
De estos, dos fueron efectivos: un medicamento llamado dobutamina, que los médicos usan para tratar los ataques cardíacos y la insuficiencia cardíaca, y el salbutamol, que está disponible bajo la marca Ventolin para tratar el asma.
Los científicos descartaron la dobutamina como un tratamiento práctico para la enfermedad de Alzheimer porque requiere inyección, y sus efectos son de muy corta duración. Además, pruebas adicionales sobre el salbutamol sugirieron que se une a moléculas de tau individuales, invitando que formen “núcleos” alrededor de los cuales se pueden agregar otras moléculas de proteínas.