El cáncer de mama es el más común entre las mujeres en todo el mundo y está aumentando, especialmente, en los países en desarrollo, ¿a qué edad deberían de empezar las mujeres a hacerse pruebas?
El cáncer de mama es el cáncer más común en mujeres, representando el 25% de todos los nuevos casos de cáncer. La clave para conseguir la curación, sin lugar a dudas, está en el diagnóstico precoz, cribado poblacional o screening, ya que permite detectar el tumor en estadios más precoces, en las cuales los tratamientos son más efectivos y el riesgo de recaída se reduce en un porcentaje muy importante respecto a estadios más avanzados.
Para la población general, se recomienda comenzar el screening a los 50 años, mediante mamografía bilateral, con una periodicidad bianual, hasta los 69 años basándose en la relación entre riesgos y beneficios. Numerosos estudios han demostrado que se puede adelantar el diagnóstico entre 2 y 4 años, detectando tumores en estadios más precoces y asintomáticos y reduciendo la mortalidad en un 20%. Su beneficio es controvertido entre 40 y 49 años.
En las mujeres mayores de 70 años tampoco hay evidencias suficientes como para recomendar el cribado de forma generalizada. Actualmente existen programas de cribado poblacional integradas dentro del Sistema Nacional de Salud, que se encargan de gestionar las diferentes comunidades autónomas. Por otro lado, existen grupos con un riesgo elevado de desarrollar cáncer que pueden ser susceptibles de beneficiarse de actividades de cribado diferentes a las planteadas, como sucede en los casos de síndromes hereditarios de predisposición al cáncer.
¿Cómo se realiza el diagnóstico de este tipo de cáncer?
El gold estándar es la mamografía. Existen dos formas de presentación: asintomático, como hallazgo de forma incidental durante la realización de los programas de cribado o sintomático ante la aparición de un nódulo mamario de rápido crecimiento, retracción del pezón, piel de naranja, expulsión de sangre por el pezón (telorragia), etc. Ante cualquiera de estos síntomas se debe consultar con su médico de atención primaria que solicitará una mamografía.
El siguiente paso es la biopsia, la cual nos dará el diagnóstico de certeza, además de una información muy valiosa: el subtipo histológico. Existen varios tipos de cáncer de mama con diferentes modalidades de tratamiento que comentaremos más adelante.
Posteriormente se debe completar con una ecografía de mama y axila para caracterizar mejor el nódulo y comprobar si existen adenopatías axilares, que en caso de ser halladas, deben ser biopsiadas.
En algunos casos se indicará la realización de una resonancia de mama para descartar multicentricidad (varios focos en la misma mama) y/o biteralidad (hallazgo de otro tumor en la mama contralateral) o en aquellas pacientes que van a recibir tratamiento con quimioterapia neoadyuvante (antes de la cirugía).
Por último se debe realizar un estudio de extensión adecuado que puede incluir radiografía de tórax y ecografía de abdomen (estadios iniciales), TAC tórax-abdomen- pelvis (estadios localmente avanzados) y gammagrafía ósea (detección de metástasis óseas). 3.
Cuando un paciente llega a la consulta, ¿cuáles son sus principales dudas e inquietudes?
El diagnóstico de cáncer siempre supone un trastorno enorme en la vida de cualquier persona y la primera sensación que se produce es el miedo a lo desconocido, al sufrimiento, a perder el control de su vida y por supuesto a la muerte.
La principal duda que suelen presentar las pacientes diagnosticadas de un cáncer de mama es si precisará o no quimioterapia. Esta duda está bien fundamentada, ya que a diferencia de otros tumores, el cáncer de mama en un gran porcentaje de casos puede no necesitarla y tratarse básicamente con una pastilla diaria de hormonoterapia durante un período comprendido entre los 5 y 10 años. Los fármacos quimioterápicos usados en este tipo de cáncer suelen producir alopecia, la cual supone un gran impacto psicológico para las pacientes, al ver distorsionada la imagen de si mismas.
Otra duda muy común es el pronóstico del tumor y las probabilidades de curación tras el tratamiento. El cáncer de mama, generalmente, se considera un tumor de buen pronóstico, en parte gracias a los tratamientos cada vez más eficaces y en parte gracias a los programas de diagnóstico precoz.
¿Se puede prevenir el cáncer de mama? ¿Qué hábitos o medidas son las más apropiadas para esta prevención?
Algunos estudios han demostrado que el riesgo de tener cáncer de mama se debe a una combinación de factores. Los principales factores que influyen en el riesgo de una persona incluyen ser mujer y la edad. Algunas mujeres tienen un cáncer de mama aunque no tengan ningún otro factor de riesgo conocido. Tener un factor de riesgo no significa que la persona vaya a tener la enfermedad, y no todos los factores de riesgo tienen el mismo efecto. La mayoría de las mujeres tienen algunos factores de riesgo, pero la mayoría de las mujeres no tienen cáncer de mama.
Los factores de riesgo se pueden clasificar en modificables y no modificables.
Entre los factores no modificables se encuentran: edad (el riesgo aumenta por encima de los 55 años), mutaciones genéticas (alteración en un gen ocasionando un síndrome de cáncer hereditario), exposición prolongada a hormonas (menarquia precoz, menopausia tardía), antecedente personal de cáncer de mama (las mujeres que han tenido un cáncer de mama tienen mayor probabilidad de tener un segundo tumor) y antecedentes familiares de cáncer de mama (predisposición genética, sobre todo en parientes de primer grado)
Entre los factores modificables se encuentran: vida sedentaria (las mujeres que no se mantienen físicamente activas tienen un mayor riesgo de tener cáncer de mama), obesidad (la grasa periférica convierte ciertas hormonas en estrógenos tras la menopausia aumentando el riesgo), tratamientos hormonales sustitutivos (algunas formas de terapia de remplazo hormonal que se toman durante la menopausia pueden aumentar el riesgo de cáncer de mama si se toman por más de cinco años), historial reproductivo (las mujeres nuligestas o con primer embarazo tardío tienen mayor riesgo), lactancia materna (las mujeres que amamantan a sus bebés durante un periodo prolongado de tiempo tienen menor riesgo de cáncer de mama) y el abuso en el consumo de alcohol (aumenta el riesgo).
Una vez diagnosticada la enfermedad, ¿cómo se aborda? ¿Es recomendable la mastectomía?
En función del estadio y del subtipo tumoral el abordaje puede ser diferente. Hay ocasiones en las que es recomendable empezar por la cirugía, que puede ser conservadora (si solo se reseca el tumor o un cuadrante de la mama) o radical (si se reseca la mama completa) y otras en las que es conveniente comenzar por quimioterapia (ya sea por imposibilidad para realizar una resección completa del tumor o para valorar respuesta al tratamiento “in vivo” en ciertos subtipos quimio- sensibles).
Respecto a si es recomendable realizar una mastectomía (cirugía radical), la respuesta es no. Varios estudios han demostrado que se consigue el mismo beneficio en supervivencia libre de progresión y supervivencia global con la mastectomía radical que con la cirugía conservadora junto a radioterapia complementaria. Por tanto, siempre que sea posible realizar una cirugía conservadora nos debemos decantar por ella, salvo contraindicación expresa (tumores multicéntricos, irradiación previa de la mama, embarazo, enfermedades del tejido conectivo, tumores inflamatorios de la mama).
¿Cree que el cáncer de mama tiene un componente hereditario?
La mayoría de los casos de cáncer de mama son esporádicos, pero se estima un 5-10% debidos a una predisposición genética hereditaria. Las mutaciones en los genes BRCA1 y BRCA2 parecen ser responsables de la mayoría de casos familiares de cáncer de mama y/u ovario de aparición temprana y del 3-4% de todos los casos de cáncer de mama. El riesgo acumulado de desarrollar cáncer de mama y/o cáncer de ovario puede llegar al 80%. El modelo de herencia es autosómico dominante, esto significa que si uno de los padres tienen alterado un gen causante de enfermedad, existe un 50% de probabilidad de trasmitirlo a su descendencia.
El cáncer de mama hereditario no se asocia con manifestaciones clínicas específicas y el diagnóstico se basa en las siguientes características: incremento del número de casos afectados de cáncer de mama en la misma rama parental (paternal o maternal), aparición temprana de la enfermedad, presentación bilateral sincrónica (a la vez) o metacrónica (segundo tumor tras superar el primero), asociación con cáncer de ovario (a cualquier edad) y aparición en varones.
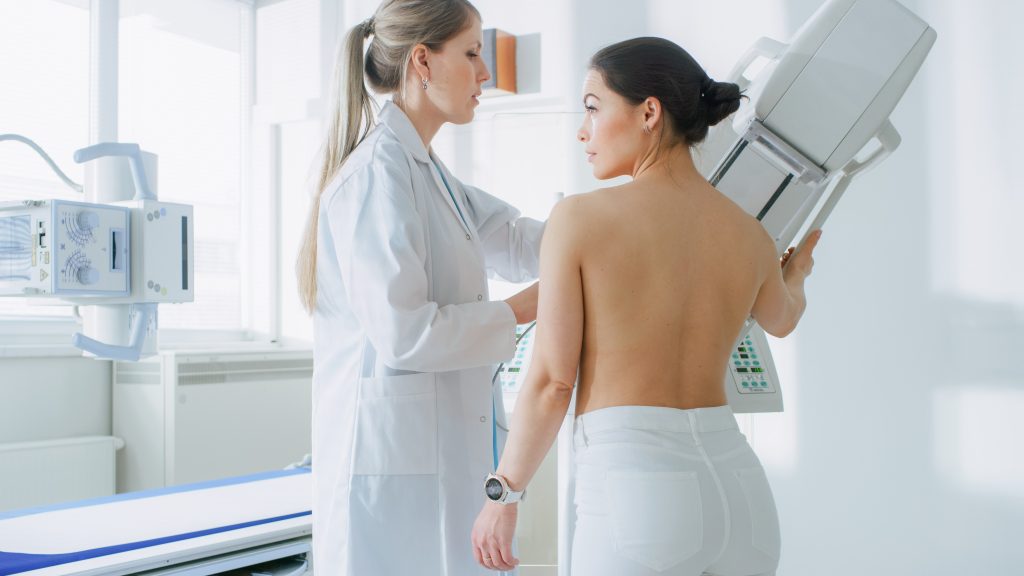
La prueba estándar para la detección de cáncer de mama esporádico es la mamografía; sin embargo, en portadoras de mutaciones en los genes BRCA, el cáncer de mama aparece a edad más temprana, donde la mama es más densa y la mamografía pierde rendimiento. Por ello, debería individualizarse, en función de las características de la paciente, la realización de mamografía con ecografía complementaria o resonancia magnética de mama. Se recomienda iniciar el cribado a los 25 años o 10 años antes del caso más joven de la familia diagnosticado de cáncer de mama.
La mastectomía bilateral profiláctica es una opción para disminuir el riesgo de cáncer de mama asociado a mutaciones en BRCA1 y BRCA2. En mujeres con antecedente de cáncer de mama y portadora de mutación en BRCA, se recomienda la mastectomía bilateral, ya que ha demostrado beneficio en supervivencia.
Para tratar los cánceres de mama, ¿existen terapias personalizadas?
Si. De hecho el tratamiento siempre debe ser personalizado en función de las características de cada fenotipo tumoral, ya que cada uno de ellos tiene un pronóstico diferente. Sin entrar en mucho detalle, existen 3 subtipos de cáncer de mama:
- LUMINAL (60-70%): Son los tumores hormono-sensibles, es decir, que expresan receptores hormonales, los cuales aprovechan para su desarrollo. En el tratamiento siempre se debe incluir una terapia hormonal que va a bloquear su proliferación. Esta terapia es diferente en función del status de menopausia. Suele administrarse entre 5 y 10 años, en función del riesgo.
- HER 2 positivo (15-20%): Son aquellos tumores que expresan en su membrana en una alta proporción de la proteína HER2/neu, la cual envía a la célula una señal de proliferación descontrolada. Hasta hace 20 años, era un factor de mal pronóstico, el cual hacía prever una evolución tórpida de la enfermedad. Con el desarrollo de los anticuerpos monoclonales, este paradigma ha cambiado y a día de hoy se considera un factor predictivo de respuesta, de tal manera que al incluir trastuzumab en el esquema de tratamiento, la evolución suele ser favorable. Se han desarrollado otros fármacos con un mecanismo similar para esta indicación.
- TRIPLE NEGATIVO (20-25%): Es el subtipo de peor pronóstico, el cual a día de hoy carece de terapia dirigida, por tanto siempre se trata con quimioterapia (salvo excepciones). Este subtipo está muy relacionado con las mutaciones en los genes BRCA 1 y 2 antes mencionadas, para las cuales existen en el mercado fármacos dirigidos (inhibidores de PARP), pero a día de hoy solo usados en el escenario de cáncer metastásico (reciente aprobación).
¿Cuáles son los principales avances que se han producido en la lucha contra este tipo de cáncer?
El cáncer de mama es probablemente el tumor en el que se han producido los mayores avances en Oncología, en parte debido a su gran prevalencia. Se han desarrollado multitud de estrategias que han ocasionado una disminución muy significativa de la mortalidad por esta causa. Además los tratamientos cada vez son más precisos y menos agresivos, evitando así las secuelas ocasionadas por los mismos. Veamos cuales son estos avances:
En el ámbito del Diagnóstico, sin lugar a dudas, el mayor avance son los programas de screening poblacional ya mencionados, pues como ya hemos dicho, la clave del éxito está en el diagnóstico en estadios precoces.
En el campo de la CIRUGIA el principal avance ha sido conseguir cada vez tratamientos más conservadores. Aparte de la ya mencionada cirugía conservadora en lugar de la mastectomía, cabe señalar la implantación de la técnica del ganglio centinela. Esto es, en lugar de eliminar todas las cadenas ganglionares de la axila (linfadenectomía), se busca al primer ganglio de la cadena de drenaje linfático y se realiza una pequeña incisión para extraerlo. Si una vez analizado se concluye que no hay metástasis, podemos afirmar con una alta seguridad que el resto de ganglios también estarán libres. Por tanto se reduce enormemente el riesgo de complicaciones derivadas de la linfadenectomía, como el temido linfedema (edematización del miembro superior por dificultad en el retorno linfático).
Las técnicas de RADIOTERAPIA, cada vez más precisas (IMRT), han conseguido disminuir considerablemente el riesgo de recaídas locales, con una mínima toxicidad. Recordemos que tras una cirugía conservadora siempre se debe administrar radioterapia para conseguir los mismos resultados que con la mastectomía.
El mayor avance en el campo de la QUIMIOTERAPIA se ha producido en la introducción de plataformas genómicas que permiten afinar con mayor precisión que pacientes se beneficiaran de la misma y cuáles no. Esto significa que podemos conocer a priori mediante una sencilla técnica de laboratorio cual es el riesgo de recidiva del tumor, clasificándolo en alto riesgo y bajo riesgo. De esta manera solo indicaremos la administración de quimioterapia a aquellas pacientes que realmente la necesiten, evitando el sobretratamiento, y en consecuencias los riesgos asociados al mismo.
Respecto a la HORMONOTERAPIA, en los últimos años se han desarrollado un grupo de fármacos, llamados Inhibidores de ciclinas, los cuales han aumentado considerablemente la supervivencia libre de progresión (esto es, el tiempo en el que la enfermedad está controlada) de aquellas pacientes con tumores metastásicos hormono- sensibles en primera línea, pasando de los 19 meses (solo hormonoterapia) a los casi 31 meses (hormonoterapia junto con inhibidor de ciclinas). Teniendo en cuenta el gran porcentaje de pacientes con este subtipo tumoral, esto debe considerarse un gran avance.
Por último, no debemos olvidar la posibilidad de reconstrucción inmediata durante la intervención, que disminuye las secuelas psicológicas que pueda ocasionar la cirugía en caso de que sea necesario realizar una mastectomía. Existen técnicas que permiten la reconstrucción con tejido adiposo del abdomen de la propia paciente mediante colgajos (DIEP), con resultados espectaculares.
Y, actualmente, ¿en qué dirección está yendo la investigación?
Hay muchas líneas de investigación abiertas, pero hay dos que resultan muy interesantes.
La realización de paneles genómicos mediante secuenciación masiva (NGS), que es capaz de detectar todas las mutaciones que presenta un tumor metastásico de tal manera que podemos usar fármacos dirigidos frente a las mismas, consiguiendo, en muchos casos, el control de la enfermedad en líneas posteriores de tratamiento con escasa toxicidad. De esta manera podemos detectar mutaciones de resistencia, valorar que fármacos pueden ser activos en determinada situación e incluir a la paciente en algún ensayo clínico que esté probando un fármaco para esa alteración en concreto.
La terapia celular CAR-T consiste en aislar los linfocitos (células del sistema inmune) que infiltran el tumor de una paciente y lo atacan, para posteriormente replicarlos en un laboratorio e introducirlos de nuevo mediante infusión. Posteriormente se administran fármacos que aumentan su actividad y de esta manera conseguimos reducir considerablemente la carga tumoral hasta el punto de poder alcanzar una respuesta completa prolongada. Es un tratamiento prometedor en el que están puestas todas las miradas, pero aún es pronto para llegar a conclusiones definitivas.
La batalla aún no está ganada pero cada vez tenemos más esperanzas en que lo terminaremos consiguiendo.